xCell:基因表达数据的免疫浸润分析专家!
hi大家,好久不见,小果又来啦!
xCell是一种基于基因表达数据的免疫细胞浸润评估工具,可以识别出潜在的免疫细胞亚群并计算它们在组织中的相对丰度。它可以广泛应用于癌症、自身免疫性疾病和其他疾病的免疫浸润分析中。
今天小果就来教大家如何实战应用xCell进行基因表达数据的免疫浸润分析,那就和小果一起来看下吧!
数据预处理
下载xCell包并导入:
install.packages(‘devtools’)
devtools::install_github(‘dviraran/xCell’)
library(xCell)
xCell免疫浸润分析
导入基因表达矩阵,并通过xCellAnalysis分析表达矩阵,该函数用于预测细胞组分在给定样本中的相对丰度:
exprSet=read.csv(“GSE57065_ExprMatrix.csv”,header=T,row.names=1)
xCell <- xCellAnalysis(exprSet) ###array data
write.csv(xCell,”xCell_score.csv”) #将计算后的结果写入表格文件中
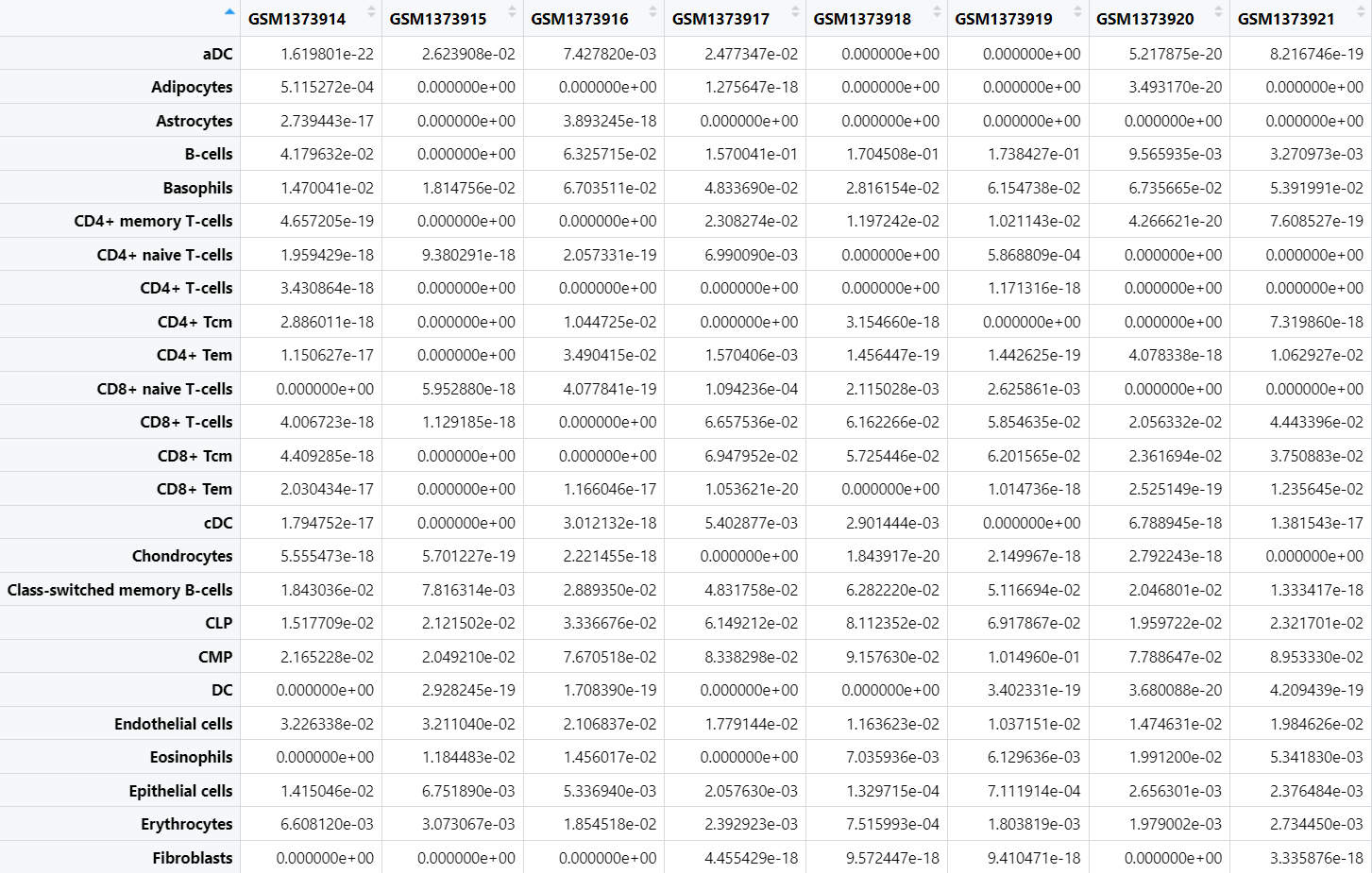 先来一起看下分析后的数据集吧!
先来一起看下分析后的数据集吧!
处理xCell分析后的结果数据集
接下来,我们可以根据样本的分组情况,提取出对应的细胞类型得分。
首先我们要读取 group.txt 的文件,这里包含了样本的分组信息,温馨提示,细胞表达样本数据包含两种类型哦!
我们可以读入这个文件,并提取出“septic_shock” 和 “healthy” 两组样本的得分:
group=read.delim(“group.txt”,header=T,stringsAsFactors = FALSE,sep=”\t”)
score=read.csv(“xCell_score.csv”,header=T,row.names=1,stringsAsFactors = FALSE)
#取出结果文件中的前64个样本,并分别取出“septic_shock”,即带有疾病的样本群和“healthy”,即健康的样本群到对应的数据集中
case_data=score[1:64,group$group==”septic_shock”]
control_data=score[1:64,group$group==”healthy”]
all(row.names(case_data)==row.names(control_data))
normal=ncol(control_data)
tumor=ncol(case_data)
normal_data=as.data.frame(t(control_data))
tumor_data=as.data.frame(t(case_data))
#合并两种类型的结果文件
rt_total = rbind(normal_data,tumor_data)
cell_group_file=read.delim(“cell_type.txt”,header=T,stringsAsFactors = FALSE)
cell_group=unique(cell_group_file$Subgroup)
xCell对分析结果下游分析
同样地,我们也可以对xCell分析的结果进行下游分析并通过小提琴图对结果进行直观的分析,和小果一起来看一下怎样操作吧!
现在我们提取出了xCellAnalysis分析后的样本数据集并做了封装处理,现在我们可以针对我们的细胞群数据进行下游分析以及可视化处理的操作。
主要的流程为:根据不同的细胞子群对样本进行分类,遍历每个细胞子群,并计算每个子群的差异显著性,并对显著差异的细胞子群进行绘图展示和保存结果。那么就让我们一起来看下代码实现吧!
for (subgroup in cell_group){
s=which( cell_group_file$Subgroup==subgroup) #获取当前细胞所属子群的index
cells=cell_group_file$Cell.types[s] #提取属于当前子群的所有细胞
rt=rt_total[,cells] #提取属于当前子群的所有细胞类型的数据,并保存在 rt 中
cell=c()
p.value=c()
for(i in 1:ncol(rt)){
normalData=rt[1:normal,i]
tumorData=rt[(normal+1):(normal+tumor),i]
wilcoxtest=wilcox.test(normalData,tumorData,exact = F) #计算其差异的 p-value,并保存在p.value中,细胞类型名称保存在cell中
p=round(wilcoxtest$p.value,3)
p.value=c(p.value,p) #合并
cell=c(cell,colnames(rt)[i])
}
sig=data.frame(cell,p.value)
sig=sig[sig$p.value<0.05,] #选出p值小于0.05的显著细胞类型
s=which(colnames(rt)%in%as.character(sig$cell))
rt=rt[,s]
all(colnames(rt)==as.character(sig$cell))
通过小提琴图可视化下游分析的结果
现在,我们可以将最终的计算结果通过小提琴图展示出来,让我们来看看具体的代码实现吧!
library(vioplot)
pdf(paste(subgroup,”Xcell_score.pdf”,sep=”_”),height=8,width=15) #设置可视化和保存的文件名称
par(las=1,mar=c(10,6,3,3))
x=c(1:ncol(rt))
y=c(1:ncol(rt))
#绘制空白散点图
plot(x,y,
xlim=c(0,(ncol(rt)-1)*3+2),ylim=c(min(rt),max(rt)+0.02),
main=”GSE57065″,xlab=””, ylab=”Xcell score”,
pch=21,col=”white”,xaxt=”n”,cex.lab=1.3,cex.main=1.5)
for(i in 1:ncol(rt)){
normalData=rt[1:normal,i]
tumorData=rt[(normal+1):(normal+tumor),i]
wilcoxtest=wilcox.test(normalData,tumorData,exact = F)
p=round(wilcoxtest$p.value,3)
vioplot(normalData,at=3*(i-1),lty=1,add = T,col = ‘#42B540FF’) #绘制正常数据的小提琴图
vioplot(tumorData,at=3*(i-1)+1,lty=1,add = T,col = ‘#925E9FFF’) #绘制肿瘤数据的小提琴图
mx=max(c(normalData,tumorData))
lines(c(x=3*(i-1)+0.2,x=3*(i-1)+0.8),c(mx,mx))
text(x=3*(i-1)+1,y=mx+0.02,labels=ifelse(p<0.001,paste0(“p<0.001”),paste0(“p=”,p)),cex = 0.8)
}
text(seq(1,((ncol(rt)-1)*3+1),3),-0.01,xpd = NA,labels=colnames(rt),cex = 1,srt = 45,pos=2,font=2)
dev.off()
write.csv(sig,paste(subgroup,”_sig_cell.csv”,sep=””)) #保存最终结果
}
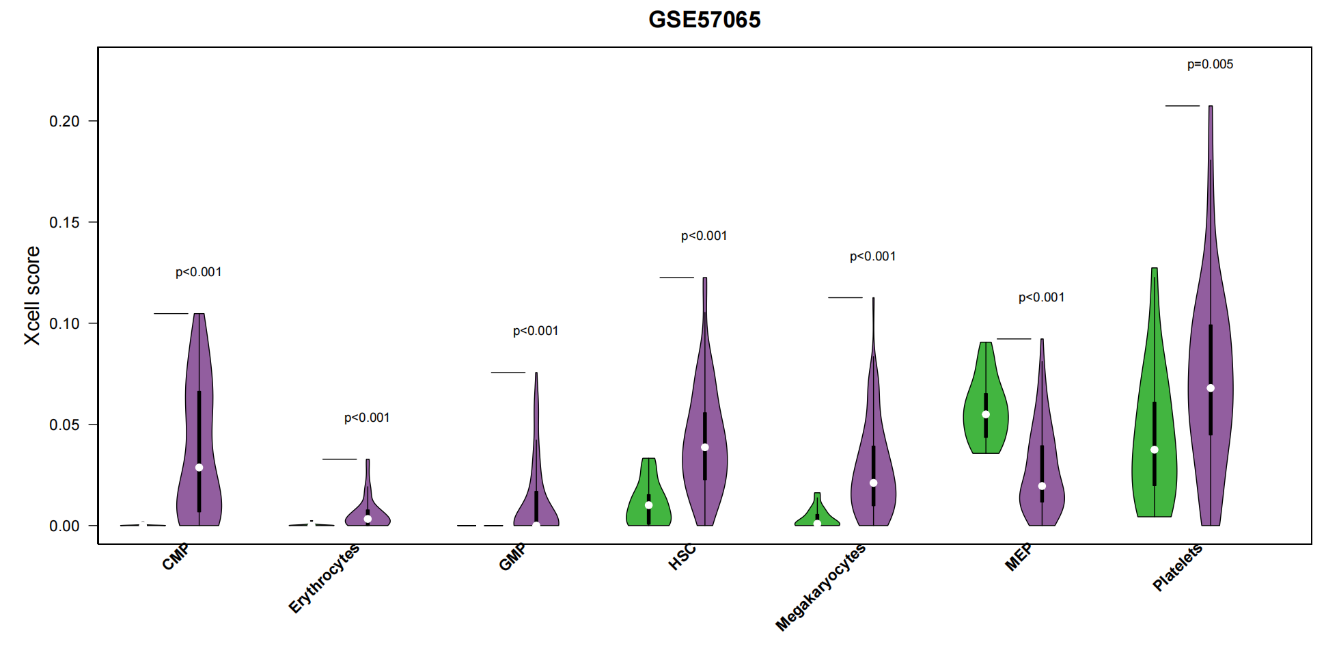 现在,你已经成功完成了xCell分析细胞到可视化的左右工作,现在小果给大家展示其中一个细胞子群的下游分析可视化结果!一起来看吧!
现在,你已经成功完成了xCell分析细胞到可视化的左右工作,现在小果给大家展示其中一个细胞子群的下游分析可视化结果!一起来看吧!
怎么样,你学会怎么使用xCell包了嘛? 更多学习资源请大家移步小果专属云生信平台搜索更多资源哦!
小果专属云生信平台:云生信 – 学生物信息学 (biocloudservice.com)
 云生信平台也有免疫专版的学习模块哦,快来找到你想学习的专属模块吧!
云生信平台也有免疫专版的学习模块哦,快来找到你想学习的专属模块吧!