
现在做空间转录组的文章越来越多了,也有不少课题组上传了空间转录组的数据,空转的公共数据正在日渐增加。如果正好有你想用的数据,这岂不美滋滋~~趁着还吃香的阶段,还不赶紧发一篇。今天小云带来的文章就教你如何单细胞结合空转分析!!
今天小云选的文章从肝细胞癌中癌症干细胞入手,通过对scRNA-Seq数据集进行大规模分析,开发并验证了癌症干细胞特征。探索了与癌症干细胞相关的富集通路和转录因子,研究了其在预后和免疫治疗中的不利作用。此外,还观察到高癌症干细胞水平的肝癌样本中SPP1+ 巨噬细胞的聚集,揭示了刺激癌症干细胞和SPP1+巨噬细胞之间相互作用的缺氧区域。此外,还利用空间转录组数据探讨了它们共定位的空间结构以及两者之间特定的细胞间通讯。文章将单细胞和空间转录组数据结合,既有一手队列,也获取了大量公共数据,分析方法多样化,内容充实饱满,又包含简单实验,干湿结合发到1区7分+!!还在寻找生信发文好思路的同学们还不赶紧码住了!!(ps:想要了解最新的生信思路,来找小云就对了,这里有不仅有热点方向还有创新思路,想思路复现可以直接扫码call小云,等你哦!)


● 题目:单细胞和空间分析揭示了癌症干细胞和 SPP1+ 巨噬细胞在缺氧区域的共定位,决定了肝细胞癌的不良预后
● 杂志:NPJ Precis Oncol
● 影响因子:IF=7.9
● 发表时间:2024年3月
研究背景
在肝细胞癌(HCC)中,正常干细胞也具有经典的癌症干细胞(CSC)标记,针对这些标记可能会阻碍肝脏再生并导致肝功能衰竭。此外,癌干细胞的空间结构仍然难以捉摸。
数据来源
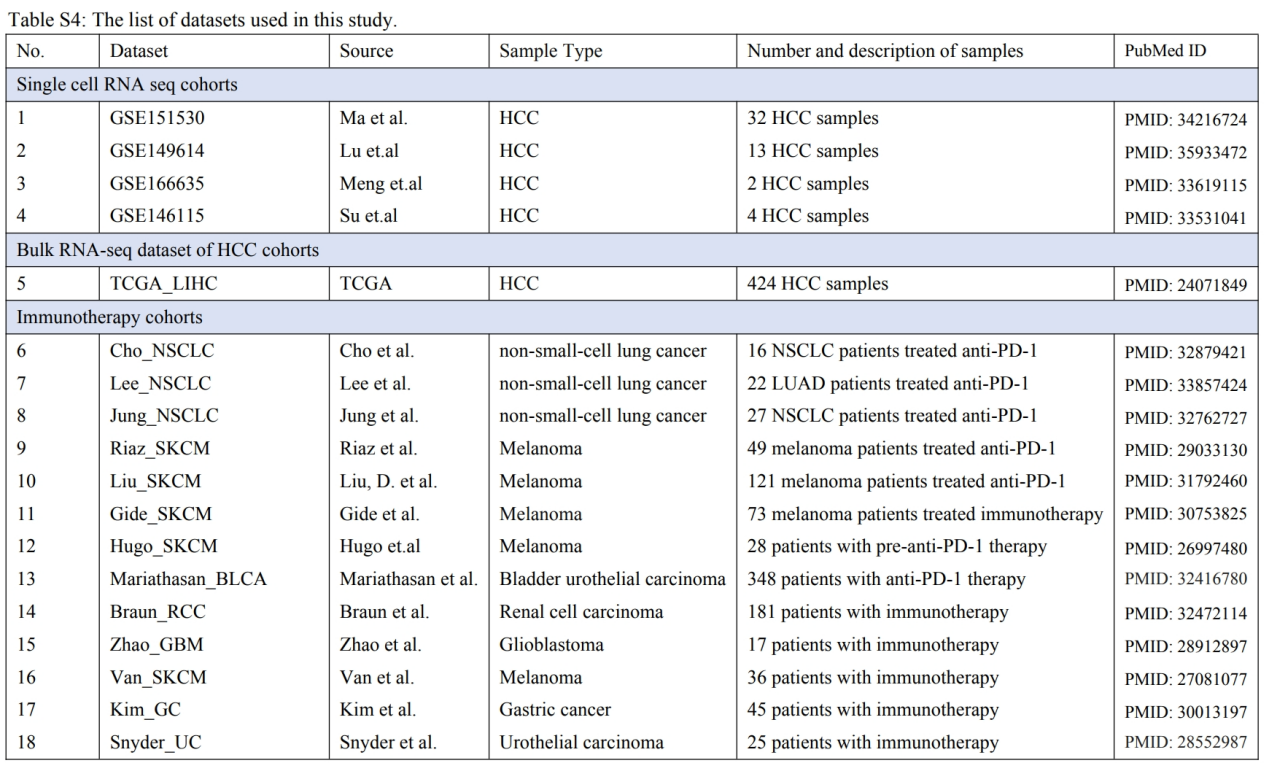
研究思路
结合单细胞数据和空间数据,以获得CSC特征并揭示其空间结构。利用 CytoTRACE 算法识别了 CSC,这些 CSC 显示出受 HIF1A 调控的上调增殖通路。然后,利用WGCNA建立了由107个基因组成的CSC特征。CSC水平较高的HCC患者表现出Macro_SPP1的聚集,并发现Macro_SPP1和CSC之间存在缺氧的肿瘤区域。探索了CSC和Macro_SPP1与预后和免疫治疗反应的关联。利用空间分析研究了它们共定位的空间结构,以及两者间的细胞间相互作用。
主要结果
1. HCC 中 CSC 的情况
本研究的工作流程如图 1a 所示。首先,研究 HCC 中 CSC 的分布情况。分析了来自 GSE151530 和 GSE149614 的总共 45 个 HCC 样本,鉴定出 81,508 个细胞用于单细胞分析。这些细胞根据经典标记分为六大类:上皮细胞、髓样细胞、成纤维细胞、内皮细胞、T 细胞和 B 细胞(图 1b)。对离散的恶性细胞进行了 inferCNV 分析。从热图来看,没有上皮亚群显示出与加标对照细胞相似的拷贝数变异(CNV)模式,因此所有上皮细胞都被标记为恶性细胞(图 1c)。
为了量化恶性细胞的干性水平,计算了CytoTRACE 分数,CytoTRACE得分在肿瘤细胞中表现出很大的异质性(图1d)。CytoTRACE评分最高和最低的25%恶性细胞分别被归类为CSC和非CSC。CSC表现出增殖相关通路的明显上调,如G2M检查点、MYC检查点和E2F靶点(图1e)。还观察到 CSC 代谢模式的显著变化,脂质代谢相关通路下调,糖酵解上调。此外,还发现免疫相关途径在 CSC 中受到抑制。
还研究了 TFs 在促进 CSC 不受控自我更新和肿瘤诱发潜能方面的活性。Dorothea被用来探索 CSC 和非 CSC 之间调节子活性的潜在差异,揭示了不同的调节子活性。图 1f显示了细胞群中 20 种变化最大的 TFs 的表达模式。在 CSC 中观察到 MYC 家族和 E2F 家族的上调,它们是细胞增殖和分化的关键因素。HIF1A是一种著名的缺氧TF,在CSC中的调节子活性增强。NRF1 的活性也有所增加,它是线粒体稳态不可或缺的氧化还原决定因子。
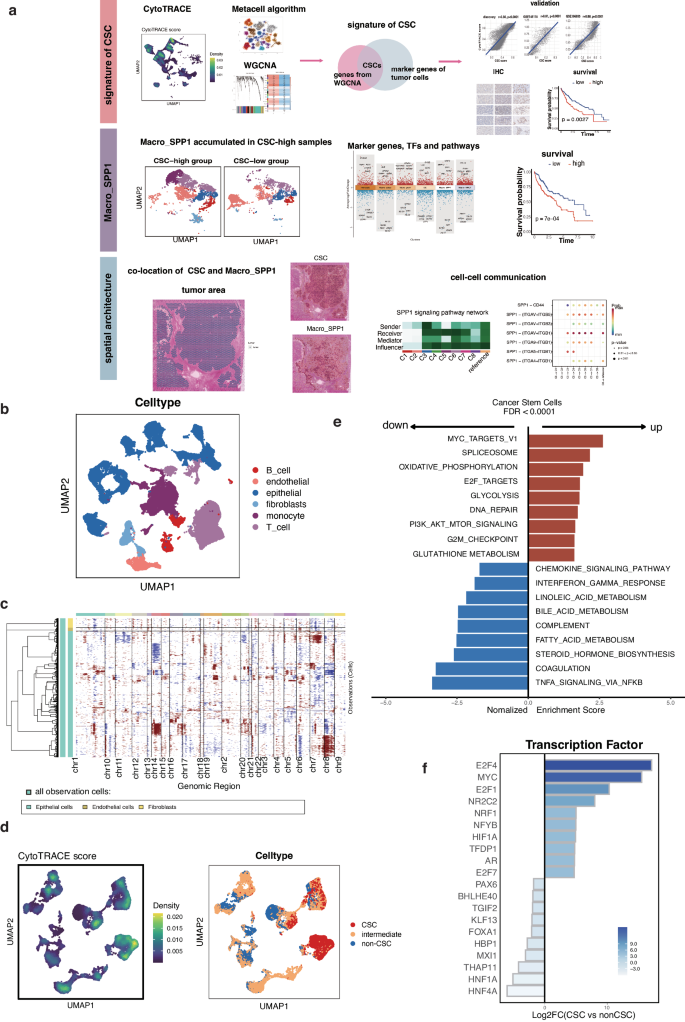
图1 单细胞水平的HCC中CSC的分布情况
2. 利用加权基因共表达网络分析确定 CSC 特征
接下来的目标是确定 HCC 中 CSC 的特征。观察到恶性细胞形成了与其样本来源相对应的不同集群,而非恶性细胞在不同患者之间没有明显差异(图 2a)。来自同一患者的恶性细胞往往属于不同的细胞群。这些发现表明,恶性细胞在患者内部和患者之间存在相当大的异质性。为了解决这种异质性对进一步加权基因共表达网络分析(WGCNA)细胞选择造成的偏差,采用了 Metacell 软件包中的非参数 K-nearest neighbor(KNN)图算法,将细胞划分为同质组。经过质量控制后,保留了 25839 个恶性细胞,并将其划分为 320 个元细胞(图 2b)。颜色相同的元细胞群具有相对相似的表达模式。这些元胞将具有相似转录状态的细胞分组,可作为近似单细胞数据中基因表达分布的构建模块。
表型可塑性模型表明,癌细胞干细胞是癌细胞中的一个动态亚群,而不是一个稳定的细胞群。越来越多的报告还显示,某些癌细胞可以通过在 CSC 和非 CSC 状态之间的可逆转换表现出可塑性,从而重新填充 CSC 池,使细胞在治疗中存活下来。利用 WGCNA 对 CSC 和非 CSC 状态之间的基因表达模式进行了细致的研究。最初纳入了来自 320 个元细胞的前 5000 个可变基因的表达谱。为了构建无标度拓扑模型,将软阈值功率设为 9(图 2c)。经过基于权重的筛选,共得到了 27 个模块,其分层聚类树如图 2D 所示。外显子相邻热图描述了所有模块间的相关性(图 2e)。然后,研究了每个模块与代表干性水平的CytoTRACE得分之间的相关性。在这些模块中,MEturquois与CytoTRACE得分的相关性最为显著(图2f)。研究发现,METurquoise 模块所包含的基因与许多增殖相关通路有关。这些通路包括G2M检查点、MYC检查点和E2F靶点,所有这些都与CSCs的特征相关。随后构建肿瘤特异性干性特征,识别了肿瘤细胞与其他类型基质细胞和免疫细胞相比的差异表达基因(DEGs)。通过将恶性细胞的标记基因与MEturquoise模块中的基因交叉,发现了107个CSC相关基因,这些基因构成了CSC特征(图2g)。
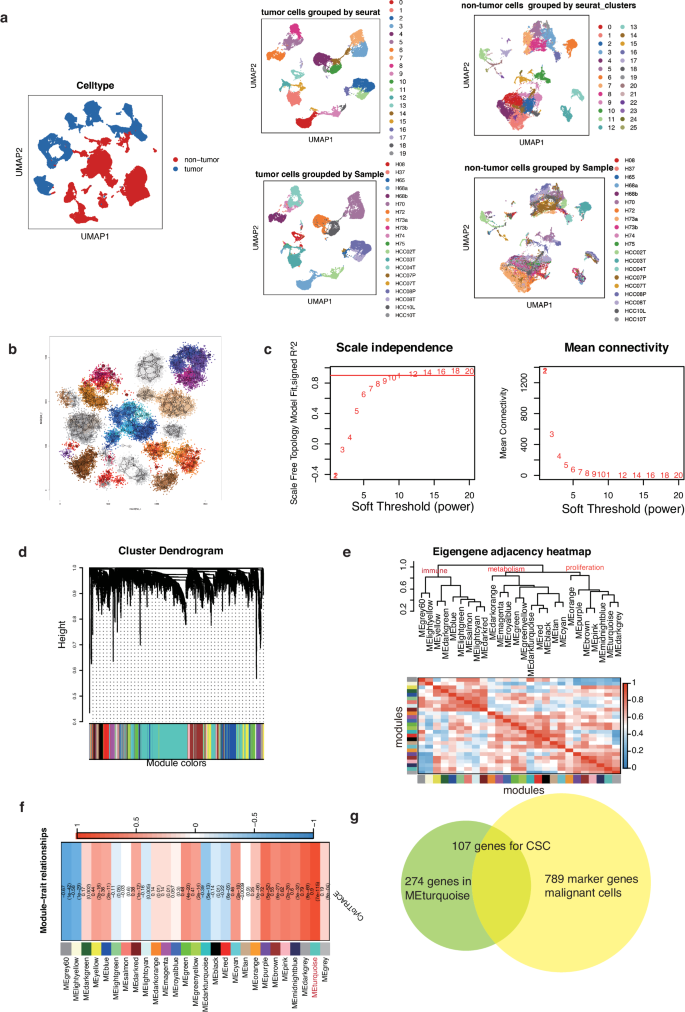
图2 利用WGCNA鉴定CSC特征
3. CSC与不良预后和不良免疫治疗反应相关
随后,为了检验所发现的 CSC 特征的可靠性,使用 AUCell 算法计算了每个恶性细胞的 CSC 得分。在发现数据集中(GSE151530 和 GSE149614 的组合),CSC 评分与 CytoTRACE 评分的相关性达到了 0.80,P 值小于 0.0001(图 3a)。为了验证这种相关性,又收集了两个 HCC 单细胞数据集(GSE166635、GSE146115),两个数据集的两个评分之间的相关性分别为 0.88 和 0.81(图 3a)。这些研究为 107 个 WGCNA 鉴定基因的有效性及其功能相关性提供了证据。
为了探索癌细胞干细胞在大体水平上的作用,分析了TCGA队列中的数据,观察到与邻近正常组织相比,癌细胞干细胞在肿瘤样本中的浸润显著上调(图 3b)。此外,CSC 的浸润随着 HCC 分期的进展而增加(图 3c)。还对内部 32 例 HCC 患者队列中 CSC 高表达的五种蛋白(ENO1、TKT、CD63、G6PD 和 KRT8)进行了免疫组织化学(IHC)检测。与这些结果一致的是,IHC 染色证实了它们与该队列中的晚期相关(图 3d 和 e)。此外,TCGA队列中CSC浸润程度较高的HCC患者总生存期(OS)较短(图3f)。
此外,还观察到与 CSC 重塑相关的 TME 成分发生了重大变化。巨噬细胞M2是免疫抑制性髓系细胞的一种亚型,与CSC呈正相关,而CD8+ T细胞与CSC呈负相关,这表明CSC与巨噬细胞M2之间可能存在相互作用,阻碍抗肿瘤细胞的浸润(图3g)。纳入了最近一项研究 GSE238264 中的 ST 数据,该研究重点关注接受免疫疗法治疗的 HCC 患者。该数据集包括来自新辅助卡博替尼(一种主要阻断血管内皮生长因子的多酪氨酸激酶抑制剂)和尼伐单抗(一种 PD-1 抑制剂)临床试验的样本,并根据治疗结果区分了应答者和非应答者。与应答者相比,非应答者的 CSC 得分更高,强调了 CSC 在免疫治疗应答中的潜在相关性(图 3h)。GSEA显示,在非小细胞肺癌(NSCLC)、皮肤黑色素瘤(SKCM)、肾细胞癌(RCC)等七种免疫疗法队列中,非应答者的 CSC 均有富集(图 3i)。这一结果为 CSC 在免疫治疗中的不利作用提供了更多证据。
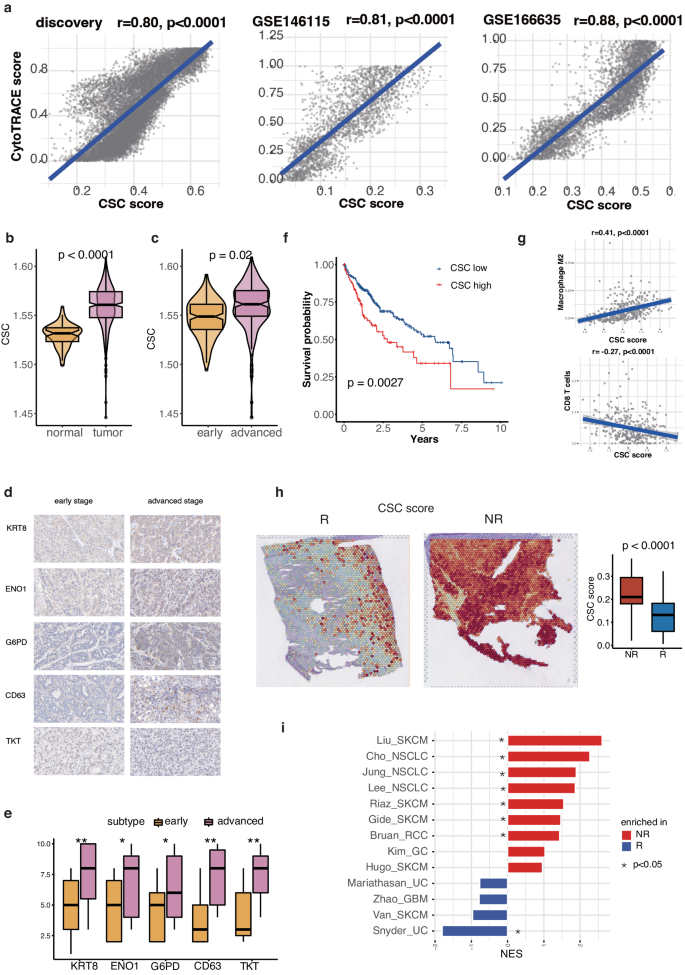
图3 CSC与较差预后和不良免疫疗法反应的相关性
4. 高CSC组中Macro_SPP1的积累
接着研究了CSC对TME的影响。每个样本的CSC得分被定义为样本中所有恶性细胞的平均CSC得分。根据所有样本的CSC得分中位数,将20个样本分为CSC高分组和CSC低分组。这两组样本的TME成分呈现出不同的景观(图4a)。与 CSC 低分组相比,CSC 高分组的恶性细胞比例明显更高。观察到 CSC 高分组与 CSC 低分组相比,髓系细胞浸润程度更高,而 CSC 低分组与 CSC 高分组相比,T 细胞浸润程度更高。不过,B 细胞、内皮细胞和成纤维细胞的比例在两组之间没有明显差异。
髓系细胞在 HCC 患者中的浸润增强,表明它们在促进 CSC 启动方面发挥着功能性作用。随后,重点研究了两组患者髓系细胞亚型的变化。首先,将髓系细胞分为六个亚群,包括DC、单核细胞、SPP1+巨噬细胞(Macro_SPP1)、MRC1+巨噬细胞(Macro_MRC1)、成脂性巨噬细胞(Macro_adipo)和增殖性巨噬细胞(Macro_prolif)。结果显示,Macro_SPP1 亚群主要出现在 CSC 高分组中(图 4b)。据报道,Macro_SPP1 是巨噬细胞 M229 的一种亚型。Macro_SPP1代表了CSC特异性巨噬细胞,占CSC高分组样本髓系细胞的23%,而在CSC低分组中仅占髓系细胞的1.8%。另一方面,表达脂质代谢相关基因(ALB、APOA2、FABP1和APOH)的成脂性髓样细胞亚群Macro_adipo在CSC低分组中的浸润程度更高。
5. Macro_SPP1表达金属蛋白酶并受HIF1A调控
与其他髓系亚型相比,Macro_SPP1 具有独特的功能。Macro_SPP1 表现出较高的金属蛋白酶表达水平,如 MMP9、MMP12 和 MMP7,它们参与细胞外基质重塑和免疫反应调节30(图 4c)。此外,Macro_SPP1 还表达 CXCL3、CCL20、CCL7 和 CXCL8 等趋化因子。在 Macro_SPP1 中高表达的 DEGs 富集于缺氧、ECM-受体相互作用、上皮-间质转化(EMT)、金属肽酶活性、KRAS 信号传导和糖酵解(图 4d)。然而,免疫相关途径,包括抗原处理和递呈、淋巴细胞介导的免疫和补体激活,在 Macro_SPP1 中受到显著抑制。这些发现表明,Macro_SPP1 可能在促进 EMT 和抑制 HCC 的免疫反应中发挥作用。
此外,Macro_SPP1 的活性可能受转录因子 HIF1A 的调控,HIF1A 是缺氧诱导通路中的一个关键因子(图 4e)。另一个转录因子FOSL1也由Macro_SPP1表达,已知它能调节侵袭和转移,与EMT和癌细胞干性有关。HSF1 能够保护细胞免受压力,避免蛋白质组不稳定,抑制肿瘤抑制性淀粉样蛋白生成。这些研究结果表明,这些转录因子的激活参与了Macro_SPP1的承诺。鉴于 CSC 和 Macro_SPP1 都与缺氧诱导途径有关,推测在肿瘤的缺氧区域内存在一个连接 Macro_SPP1 和 CSC 的局部网络,共同加剧了 HCC 的微环境。
为了验证Macro_SPP1浸润的重要性,分析了来自TCGA队列的数据,观察到与邻近正常组织相比,肿瘤样本中Macro_SPP1的浸润显著上调(图4f)。Macro_SPP1 的浸润随着 HCC 病期的延长而增加(图 4g)。此外,TCGA队列中Macro_SPP1浸润程度较高的HCC患者的OS较短(图4h)。免疫治疗队列中的非应答者与应答者相比表现出更高的 Macro_SPP1,强调了 Macro_SPP1 在免疫治疗应答中的潜在相关性(图 4i)。
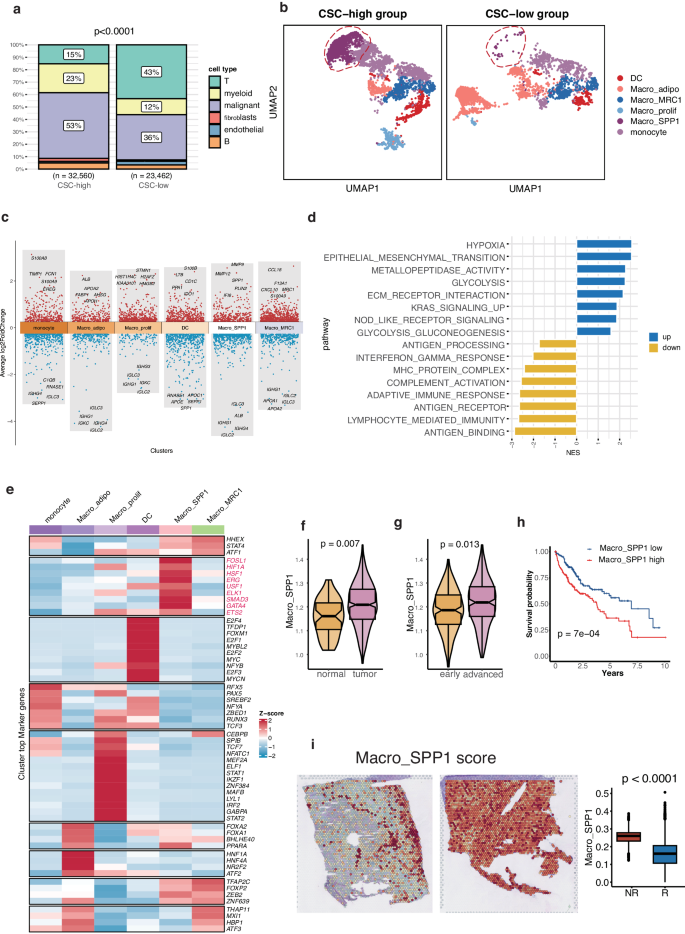
图4 Macro_SPP1表达金属蛋白酶,并受 HIF1A 调节
6. 通过空间转录组学揭示 CSC 和 Macro_SPP1 的共定位
为了研究 CSC 和 Macro_SPP1 的空间组织,使用 8 例 HCC 患者的肿瘤组织切片进行了空间转录组学测序。获得了所有样本中位数为 4900 个点的转录组学数据。与单细胞数据分析的复杂性类似,仅根据 ST 数据中的基因表达模式识别恶性细胞也具有挑战性,尤其是在区分恶性细胞和正常上皮细胞时。为了解决这一复杂问题,进行了推断 CNV 分析,根据 CNV 模式从其他细胞类型中特异性地划分出恶性细胞。
推断CNV分析的过程包括两个聚类阶段。首先,在第一个聚类阶段,利用 Seurat 软件包对 ST 数据进行降维和聚类。运行 PCA 降维后,使用 Seurat 软件包中 FindClusters 功能中的 KNN 算法对空间点进行聚类。样本 1 中的 4825 个点被分成 14 个不同的聚类(图 5a)。根据一系列免疫相关特征,包括泛免疫标记(PTPRC)、泛 T 细胞标记(CD2、CD3D、CD3E、CD3G)、B 细胞标记(CD79A、MS4A1、CD79B)和髓样细胞标记(CD68、CD14),计算出每个点的 “正常得分”,代表每个点内免疫特征的平均值。在第一次聚类分析中,正常得分最高的聚类 8 被指定为推断 CNV 分析的参考聚类(图 5b)。
然后,在第二聚类阶段,基于树划分的分层聚类方法根据 CNV 模式将除参照聚类外的所有斑点划分为八个聚类(图 5c)。CNV得分较高的簇1、簇2和簇3被确定为恶性簇(图5d)。与 CNV 分析结果一致,簇 1、簇 2 和簇 3 与分散的肿瘤区域相对应,而其他簇主要由正常肝细胞、成纤维细胞和混合免疫细胞组成(图 5e)。
为了评估 CSC 和 Macro_SPP1 的存在,使用单细胞分析得出的特征对该样本中的斑点进行了评分。观察到样本中存在大量的 CSC 异质性,这在很大程度上受到其空间模式的影响。CSC 特征得分主要在肿瘤簇中检测到(图 5f)。三个肿瘤集群表现出明显的 CSC 特征,其簇3 的 CSC 评分最高(图 5f)。CD24和CD44是众所周知的CSC标记物,在簇3中高表达(图5g)。观察到Macro_SPP1 在簇3 中靠近 CSC(图 5h)。此外,Macro_SPP1还聚集在簇3的肿瘤边界附近,构成了维持CSC的免疫抑制前沿。簇3 的 CSC 和 Macro_SPP1 水平最高(图 5i)。这表明 CSC 和 Macro_SPP1 在龛内存在物理相互作用。
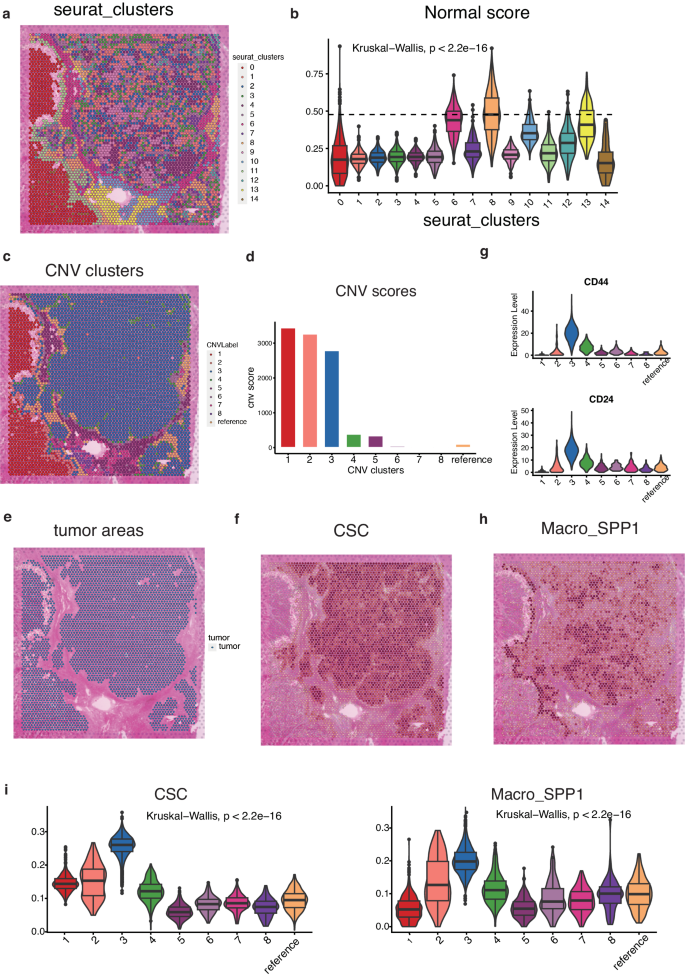
图5 肿瘤区域CSC和Macro_SPP1的共定位
7. HIF1A和HAVCR2在共定位区域的边界高度表达
然后,对样本 1 中 CNV 簇的表型进行了研究。图 6a 显示了 CNV 簇中六种细胞类型(上皮细胞、骨髓细胞、成纤维细胞、内皮细胞、T 细胞和 B 细胞)的标记基因。作为上皮细胞标记基因的 EPCAM、KRT8 和 KRT19 在簇 1、簇 2 和簇 3 中高表达。簇 3 还显示出 CD68(骨髓细胞标记)和 PLVAP(内皮细胞标记)的高表达。簇 4 显示 PLVAP 的高表达。簇 5 表现为以 VWF 为标志的内皮细胞、以 CD14、CD163 和 FCGR3A 为标志的髓样细胞以及以 DCN 为标志的成纤维细胞的浸润。簇 6 的特征是 T 细胞聚集(CD3D、CD3E 和 TRAC)和骨髓细胞(CD68),而簇 7 和簇 8 则主要由以 CD163 为标志的骨髓细胞浸润。显示最高正常值的参照群包含免疫细胞和基质细胞,如成纤维细胞(COL1A1 和 COL1A2)、内皮细胞(PLVAP 和 PECAM1)、T 细胞(CD3D、CD3E 和 TRAC)和 B 细胞(MS4A1 和 CD79A)。
肿瘤边界是由实体瘤最外圈的恶性细胞和空间结构上紧密相邻的非恶性细胞组成的壁龛,是这些不同空间区域的桥梁。为了进一步阐明 CSC 的空间结构,对簇 3 的边界区域进行了研究。簇 3 最外圈附近最近的 3 个点宽度区域被定义为其肿瘤边界区域,包括所有簇(图 6b、c)。CD8A 是 CD8 T 细胞的标记,仅在簇 6 表达,表明抗肿瘤免疫细胞被排除在肿瘤区域之外(图 6d)。众所周知的缺氧因子 HIF1A 在簇 3 及其边界簇中被观察到,突显了缺氧在重塑 CSC25 的 TME 中的关键作用(图 6e)。作为重要免疫治疗靶点的 PDCD1、CTLA4 和 CD274 在所有区域几乎都没有表达,而 HAVCR2 则在簇 3 的边界区域有显著表达,表明这是一个潜在的免疫治疗靶点(图 6f)。
此外,还在肿瘤边界的肿瘤区和非肿瘤区发现了富集的通路,这些通路有助于形成肿瘤龛。肿瘤区域富集的通路主要与 ECM 组织、血管生成、细胞周期和细胞基质粘附有关(图 6g)。观察到缺氧是 CSC 和 SPP1+巨噬细胞共定位区域内最富集的通路(图 6g),这表明在缺氧微环境中这些元素之间存在重要的相互作用。这一发现表明,Macro_SPP1 和 CSC 的共定位可能在细胞迁移、粘附和 ECM 组织中发挥作用。非肿瘤区富集的通路主要与 T 细胞介导的细胞毒性和淋巴细胞介导的免疫、趋化因子信号转导和补体有关。因此,去瘤细胞微环境有可能受到 CSC 与 Macro_SPP1 之间相互作用的调控,从而限制免疫细胞浸润肿瘤核心。
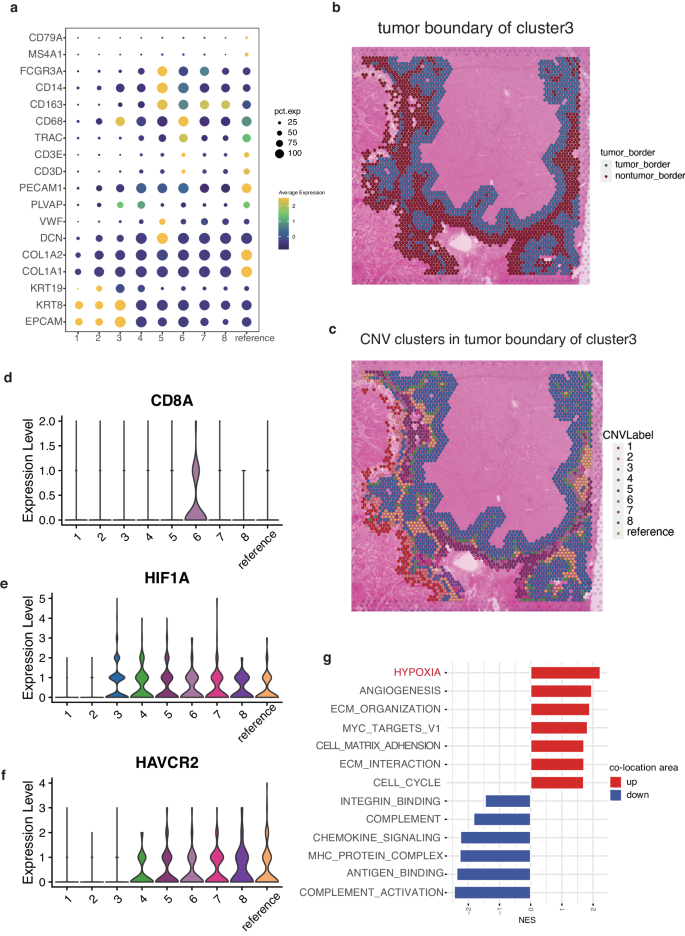
图6 HIF1A 和 HAVCR2 在共定位区边界高表达
8. 细胞-细胞通讯中的 SPP1 信号传导
进一步研究了Macro_SPP1和CSC之间的相互作用以及它们共处一地对边界区域的影响。利用 CellChat 在单细胞水平上分析了 CSC 与其他主要细胞类型之间的通讯互动并识别了通讯分子。首先在单细胞水平上评估了它们之间的假定串扰(图 7a)。在 CSC 与 Macro_SPP1 之间的交流中观察到了 SPP1 信号通路,其中 SPP1 与 CSC 上的 CD44、ITGAV、ITGA5、ITGB1 和 ITGB5 相互作用。CD44 是众所周知的 CSC 标记,揭示了它在调节 TME 重塑中的新作用。在 Macro_SPP1 的自我通讯中观察到了 LGALS9-HAVCR2,据报道它能在 TME 中产生免疫抑制作用。此外,MIF 在两组之间表现出明显的高活性,通过 CSC 信号激活 Macro_SPP1 中的 CD74、CD44 和 CXCR4。此外,CSC 释放的趋化因子(CCL3、CCL16 和 CCL15)会靶向在 Macro_SPP1 中表达的 CCR1。综上所述,这些靶点在免疫抑制反应中发挥着重要作用。
接下来重点转移到了边界区域的通讯上,其中簇 3 是最活跃的簇,参与了许多传入和传出的相互作用(图 7b)。因此将注意力集中在簇 3 与所有簇之间的细胞间通讯上。簇 3 激活了各种信号通路,包括 SPP1、MIF、COMPLEMENT、MK 和 AGT(图 7c)。在所有通讯活动中,SPP1 信号通路的相对强度最高。簇 3 是 SPP1 信号通路的主要发送者,而簇 3、4、5、6、7 和边界区域内的参照群簇则是 SPP1 信号的接收者和影响者(图 7d)。这些发现与单细胞水平结果一致,证明了 SPP1 与 CSC 上的 CD44、ITGAV、ITGA5、ITGB1 和 ITGB5 相互作用(图 7e)。总之,这些结果凸显了 SPP1 信号在介导 Macro_SPP1 与 CSC 之间的相互作用中的重要作用,以及它们在边界区域共定位所产生的影响。
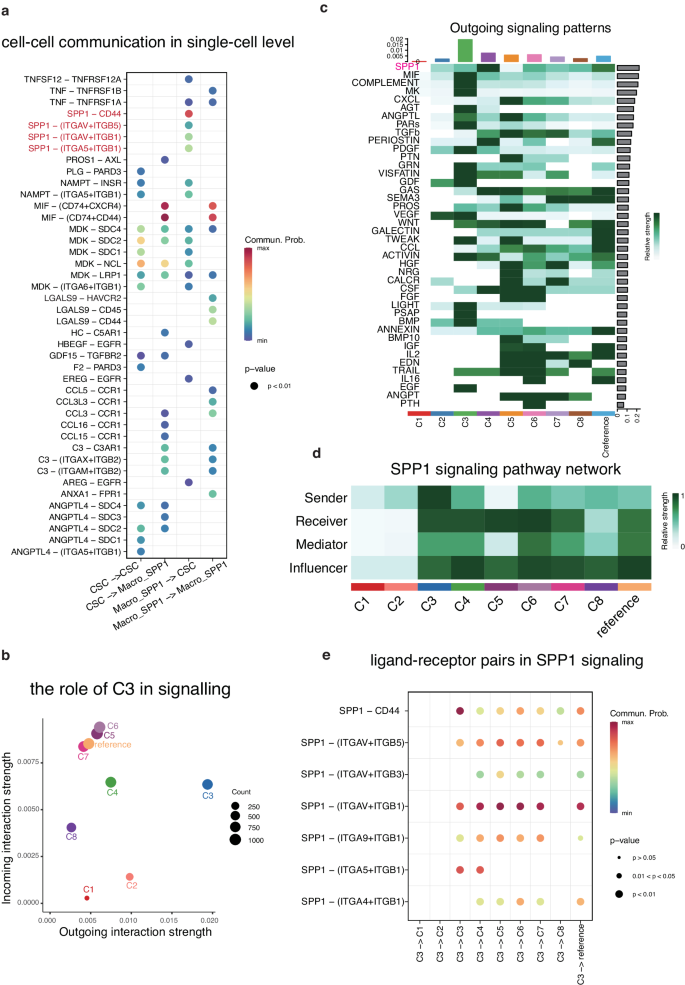
图6 细胞-细胞通讯中的 SPP1 信号传导
文章小结
该研究通过结合单细胞和空间转录组数据,以获得CSC特征并揭示其空间结构。利用CytoTRACE 算法和WGCNA,鉴定了CSC并开发了CSC特征。CSC 水平高的 HCC 患者表现出Macro_SPP1的积累,表明缺氧肿瘤区域连接Macro_SPP1和 CSC。CSC 和 Macro_SPP1 都与较差的预后和不良的免疫治疗反应相关。空间分析显示 CSC 和 Macro_SPP1 位于同一位置。在共定位区域内,SPP1信号通路在细胞间通讯中最为活跃,其中SPP1-CD44和SPP1-ITGA/ITGB被确定为主要的配体-受体对。文章分析层层递进,思路十分清晰,分析数据包含了一手和公共数据,采用了多种分析方法,逻辑非常严谨,干湿结合拿下1区7分+稳稳当当!!(ps:发文还缺好思路的同学们,欢迎来找小云,超多新颖的分析思路供你选择哦!)
